- Home
- 保険医新聞掲載, 正しく扱い味方につける!「統計」のミカタ
- 日常診療からのエビデンス
日常診療からのエビデンス
- 2021/11/5
- 保険医新聞掲載, 正しく扱い味方につける!「統計」のミカタ
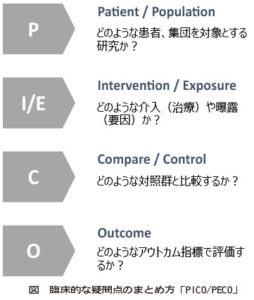
 第三回目の今回はいよいよ日常診療からエビデンスをまとめていくお話をしたいと思います。研究を始める上で、皆さんの臨床的な疑問点(Clinical Question:CQ)を整理する必要があります。CQのまとめ方でよく使われているのは、PICO/PECOです。P(Patient/Population)はどのような患者、集団を対象とした研究か、I(Intervention)治療介入、またはE(Exposure)曝露状況か、C(Compare/Control)どのような対照群と比較するのか、O(Outcome)アウトカム指標は何で評価するのか、を考えます。
第三回目の今回はいよいよ日常診療からエビデンスをまとめていくお話をしたいと思います。研究を始める上で、皆さんの臨床的な疑問点(Clinical Question:CQ)を整理する必要があります。CQのまとめ方でよく使われているのは、PICO/PECOです。P(Patient/Population)はどのような患者、集団を対象とした研究か、I(Intervention)治療介入、またはE(Exposure)曝露状況か、C(Compare/Control)どのような対照群と比較するのか、O(Outcome)アウトカム指標は何で評価するのか、を考えます。
 例えば、「早期大腸がん(StageⅠ)の術後患者(P)のうち運動介入を行った患者(I)と行わなかった患者(C)における5年生存率(O)の違い」を見るような研究など、PICOが書ければ、研究の課題名が決まります。第1回目、2回目で学んだ、論文の読み解き方を参考に、過去の研究について調べ、ご自身の研究課題において、まだ研究成果の報告がないのかどうかを検討してみてください。
例えば、「早期大腸がん(StageⅠ)の術後患者(P)のうち運動介入を行った患者(I)と行わなかった患者(C)における5年生存率(O)の違い」を見るような研究など、PICOが書ければ、研究の課題名が決まります。第1回目、2回目で学んだ、論文の読み解き方を参考に、過去の研究について調べ、ご自身の研究課題において、まだ研究成果の報告がないのかどうかを検討してみてください。
実際に研究を行う上では、研究のデザインを検討します。研究テーマから考えて介入研究がよさそうですが、過去に診療の中で、実施してきたデータが蓄積されている場合には、まずは、観察研究として、エビデンスを整理してみましょう。パイロットスタディや過去に行ってきた治療のデータに基づいたサンプルサイズ設計が必要になりますので、いきなり無作為化比較試験を計画することはできません。ご自身の診療の中で蓄積された患者さんの情報を用いて、情報を整理していきます。
診療情報を用いた臨床研究を行う上で、気をつけなければならない点は、第一回目にも記載しましたが、研究の目的で収集されたデータではないという点です。研究に使いたい情報が必ずしもカルテやシステムのデータベースの中にあるとは限りません。
その場合には、きちんと評価すべき主要アウトカム指標(プライマリ・エンドポイント)や、副次的アウトカム指標(セカンダリ・エンドポイント)を設定し、前向きに症例を収集して研究を行う必要があります。また、介入・曝露とアウトカムに関連する交絡因子となりうるデータも十分に収集しておく必要があります。
研究デザインについては、大阪医科薬科大学医師会報にて連載しておりますので、ご参照いただければ幸いです(※1)。
研究デザインを決定したら、研究計画を考えますが、研究デザインごとに報告ガイドラインがあります。EQUATORネットワークのウェブサイトで各研究デザインに応じたガイドラインを掲載しています(※2)。こちらは英語ですが、日本語訳されたものも、いくつかあります。無作為化比較試験の場合はCONSORT声明(※3)、観察研究の場合はSTROBE声明(※4)、RWDデータを使用した研究はRECORD声明(※5)をご参照下さい。
※1:大阪医科薬科大学医師会報第52号~ シリーズ・かなり役立つ医療統計
※3:CONSORT 2010 声明 ランダム化並行群間比較試験報告のための最新版ガイドライン『薬理と治療(2010年38巻11号)』P933-936に掲載
※4:疫学における観察研究の報告の強化(STROBE声明): 観察研究の報告に関するガイドライン
※5:日々の診療情報を用いた研究報告の質向上への提案 : RECORDの日本語版について『医療の質・安全学会誌( 2017年第12巻第4号)』P413-417 に掲載